肺癌の診断と治療
【肺癌の診断】
蛍光気管視鏡
青色励起光が上皮下層に達すると,自家蛍光が発生します。
蛍光観察とは,その自家蛍光を画像化することで,従来の内視鏡観察では発見・診断が難しい早期肺癌や前癌病変を,蛍光の強度あるいは色調の違いとして表示し,病変部の発見・診断を容易にするものです。
当科では現在AFI (Auto Fluorescence Imaging) (OLYMPUS社製)による蛍光観察を施行しています。
AFIは青色励起光だけでなく、血中に含まれるヘモグロビンに影響を受けやすい緑色の反射光を用いることで,血液が豊富な部位や出血,血管と腫瘍性病変の識別能力の向上が期待できる利点を備えています。
正常組織はグリーン,粘膜の肥厚などにより蛍光の減弱した腫瘍性病変はマゼンダと従来の蛍光観察装置と比べ最も視認性の高い色調による蛍光観察画像が得られます。
①中心型早期肺癌の発見,
②手術前の切除線の決定,
③レーザー治療におけるより正確な浸潤範囲の評価→有効な照射野の決定,
④精度の高い治療効果判定, を目的として使用しています。
細径気管視鏡
気管視鏡は挿入部径,鉗子チャンネル径,画質により観察用,処置用,細径気管視鏡に分けられています。
観察用は画質を最優先にした気管支鏡で,2mm未満の鉗子チャンネル径,6mm前後の挿入部径をもっています。
処置用は6mm前後の挿入部径に2.6mm以上の太い鉗子チャンネル径をもっています。
細径気管視鏡は末梢病変,気道狭窄時,小児への使用などのために5mm前後からそれ以下の挿入部径をもっています。
当科では外径2.8mm 鉗子チャンネル径1.2mmのものを使用しています。
細径気管視鏡の用途として,当科では主に,CTガイド下での気管視鏡生検やCTガイド下でのコイルマーキングに汎用しており,末梢肺野病変へのアプローチを良好なものとしています。
超音波気管支鏡(図1,2)
超音波気管支鏡は、気管支鏡の先端に超音波を発生する装置が設置されている気管支鏡であり、気管支の先端から超音波を発生することにより、気管支の内側から気管支壁内外の病変が観察できることが最大の特徴です。超音波気管支鏡は肺癌の浸潤範囲や気管支壁外からの癌浸潤の診断あるいは肺の入り口(肺門)・左右の肺の間の部分(縦隔)のリンパ節腫脹・転移の診断などに非常に威力を発揮し、現在では気管支壁内外の病変の診断には不可欠なものとなっています。
また、当院では平成16年から超音波ガイド下に直接気管支壁外病変の穿刺ができる超音波気管支鏡を導入しており、以前のものと比較して安全でかつ正確な穿刺吸引細胞診が可能となり、高い確率で確定診断が得られています。
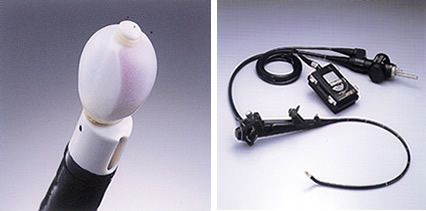
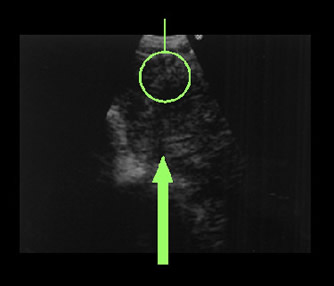
超音波気管支鏡(図2)実際の超音波気管支鏡像
腫瘍マーカー(表1,2)
腫瘍マーカー検査は採血を行うのみで結果を簡便に得ることができ、肺癌診療にとって不可欠な臨床検査です。
腫瘍マーカーの高値のみでは肺癌の確定診断は得られませんが、悪性腫瘍の補助診断、治療効果や癌の再発の判定、予後の予測などに広く用いられています。
肺癌に対する主な腫瘍マーカーを表に示します。
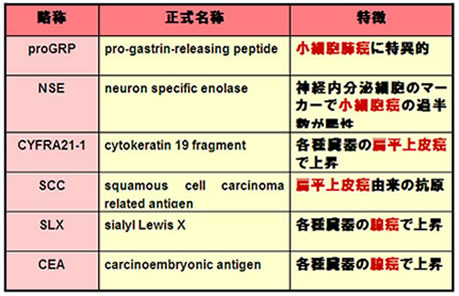
肺癌の主な腫瘍マーカー(表1)
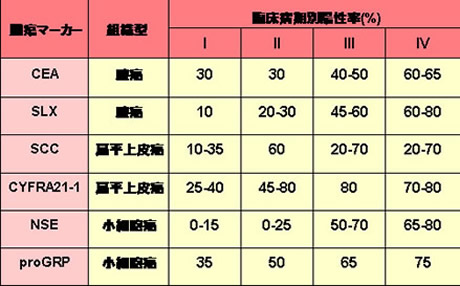
肺癌における腫瘍マーカーの陽性率(表2
【肺癌の進行度(病期診断)と治療】
肺癌と診断されたら、癌がどの程度進んでいるのかを、胸部写真、胸部CT、上腹部CT、PET-CT、脳MRI、血液検査(腫瘍マーカーなど)により評価します。
この臨床病気診断は、治療法の選択の上でも重要となります。
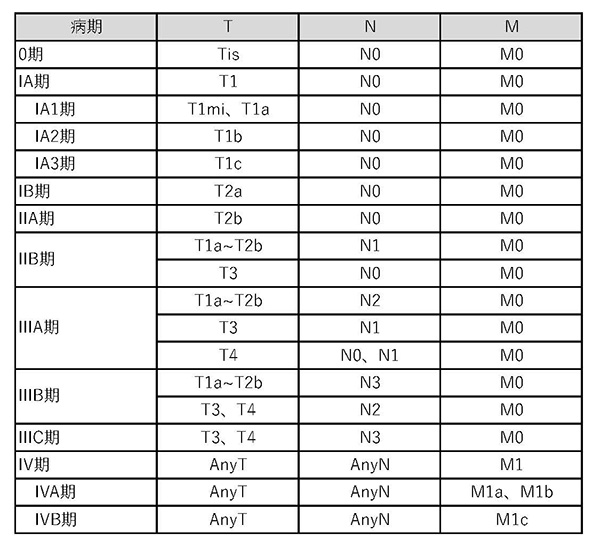
肺がんの進行状況(病期)
T:もとの“がん”の広がり N:リンパ節への広がり M:他の臓器への広がり この3つの情報をもとに、以下の8つの段階に分けられています。
M1 O期は上皮内癌といい、癌の浸潤が認められないもっとも早期の癌です。
肺に腫瘤陰影を認める一般的な肺癌では、IA期が最も早期で、IV期がもっとも肺癌が進行した状態となります。
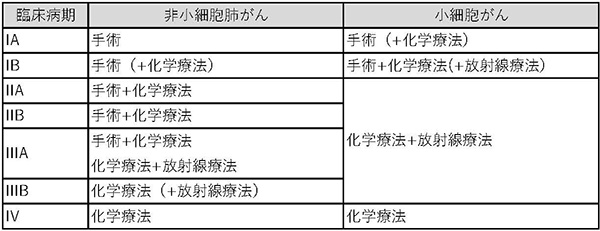
臨床病期診断による標準的な治療法の概略を次に示します。
肺癌に対する治療の主体は、手術、化学療法(抗癌剤による治療)、放射線治療であり、臨床病期や患者さんの状態によりそれぞれの治療単独や組み合わせにより治療がなされます。
免疫療法は現時点では上旬的な治療ではなく、当院では臨床試験肺癌は小細胞癌と小細胞肺癌以外の非小細胞肺癌では、病状の進み方が異なり、治療法も異なります。
肺がんの病期分類
【非小細胞癌の治療】
外科治療
現在、肺癌に対する標準的治療法は肺葉切除術+リンパ節郭清です。
右肺は上葉、中葉および下葉に、左肺は上葉と下葉に分かれています。
右上葉の肺癌に対しては右上葉を切除します。癌が大きい場合や、癌のできた場所や浸潤によっては、二葉切除や一側肺全摘出術が選択される場合があります。 そのほかには、肺区域切除や肺部分切除が選択される場合があります。
これらは、肺葉切除に比べて、切除肺容量が少ないため、術後肺機能の減少量は肺葉切除に比べて少なくてすみます。
肺区域切除や肺部分切除はリンパ節転移がないと考えられる、早い時期の肺癌において選択される術式です。
肺癌に対する肺葉切除+肺葉切除が標準術式と考えられているため、肺区域切除や肺部分切除は縮小手術と呼ばれています。
縮小手術でも充分に肺癌の根治性が担保されると考えて当該術式を選択する場合を積極的縮小手術と呼びます。
これに対して、患者さんの全身状態や、肺機能が悪いため肺葉切除が行えず、肺区域切除や肺部分切除を行う場合がありますが、この場合は消極的縮小手術と呼んでいます。外科治療の選択に当たっては、肺癌の臨床病期診断を十分に行うとともに、呼吸機能や全身状態(心肺機能、肝機能、腎機能、血液凝固能、貧血の有無、術前合併症の有無など)を評価することが重要となります。
外科治療以外の代替治療なども考慮したうえで、ご本人、家族と十分に相談したうえで手術を受けていただくことになります。
胸腔鏡補助下肺葉切除術(VATS; video-assisted thoracic surgery)
呼吸器外科手術として、肺切除が行なわれたのが1910年、肺腫瘍の手術報告は、1921年でした。
以降肺癌手術は、1942年に肺葉切除、1960年に気管支形成術と縮小の方向へ進歩してきました。
そして1990年代に胸腔鏡下手術法(VATS)が開発され、急速な展開をとげつつあります。90年代前半はこの新しい手術手技の修得の時期で、90年代後半から症例の蓄積によりVATSの有用性が示され、各種疾患に対する適応が検証されてきました。
VATSの適応疾患は、当初より良性疾患である気胸・肺嚢胞・肺気腫・良性腫瘍などが主でしたが、最近は転移性腫瘍・肺癌などにも適応が拡大されてきています。
当科でも、90年代後半から肺癌の肺葉(右上葉・右中葉・右下葉・左上葉・左下葉)切除に対してもこの手技を導入し、約7cm程度の皮膚切開(肋骨・筋肉温存)と2~3箇所の穴(12mm)で肺葉切除を行っています。2018年10月から、肺がんに対する da Vinci Xi によるロボット支援下手術も開始しています。
術後、翌日から食事開始し、術後創痛が軽減されるため離床が可能です。
以前の20cm以上の切開(肋骨・筋肉切開)に比べ、入院期間も短縮され、術後1週間程度で退院が可能となりました。
当科では、年間106例(2018年度)の原発性肺癌に対し、全例径5mmの胸腔鏡(先端が自由に曲がり通常見えないところも観察可能)を併用し、約70%程度小切開で完遂しています。
術中の癒着や出血に対しては、患者さんの安全を第一に追加皮膚切開を行っています。 94年~03年までの原発性肺癌の手術死亡(1.6%)、在院死亡(5.8%)であったのに対し、現在は、術前の状態の評価をマルチスライスCT・ PET-CT・MRIなどによって詳細に評価し、足底間欠的血行刺激装置の導入・周術期管理の向上などにより、04~06年の手術死亡(0%)、在院死亡 (0.9%)と有意に低下しています。
CTガイド下気管支鏡コイルマーキング
[小型末梢肺病変に対する手術]
近年、CTの進歩により胸部写真では指摘できない、画像上すりガラス陰影(Ground Grass Opacity: GGO)を呈する肺腺がんが増加しています。多くは非浸潤がんもしくは微小浸潤がんであり、非常に予後良好であることが報告されています(Am J Surg Pathol 2009)。
さらに、低線量CTを用いた検診が肺がんの死亡率を低下させたという報告が出たことからも(N Engl J Med 2011)、今後このような病変が発見される機会が増加すると予想されます。すでに早期肺がんのCT所見に関する前向き研究(JCOG0201)がなされ、2㎝以下で、consolidation/tumor ratio≦25%のGGO病変が特異度98.7%で早期肺がんであることが証明されました(J Thorac Oncol 2011)。さらに、CT上早期肺がんと考えられる病変に対する縮小手術の有用性に関する第II相試験(JCOG0804/WJ4507L)もすでに症例集積が終了し、今後の流れとしては、CT上早期肺がんの疑われる病変に関しての縮小手術はコンセンサスが得られることが予想されています。
一方で、これらの病変の多くは胸腔鏡のみで正確に場所を同定することは困難で、小さな手術創から手を入れて触診することも不可能であるため、切除の際には何らかのマーキングが必要になってきます。術前に経皮的に病変部近傍にフックワイヤーを留置し、それを目印に胸腔鏡下に切除するという方法を採用している施設が多いです。当科でも当初はその方法を採用していましたが、空気塞栓による死亡例を経験して以来(Sakiyama S, et al. JTCVS 2003)、われわれは、これらの病変に対して、CTガイド下に気管支鏡を用いて経気管支的に腫瘍の近傍に血管塞栓用コイルを留置し、後日胸腔鏡下にCアーム透視下に切除するという独自の方法を開発し、症例を重ねています(Toba H, et al. EJCTS 2013)。当科ではすでに2017年8月までに144例(157病変)に対して、本法を施行し、合併症は1例(0.7%)のみ軽度の気胸を認めたのみと安全に施行できており、全例で術中にコイルを確認し、十分なマージンをもって切除できています。本法のメリットとして、①手技が安全で合併症が少ない、②完全鏡視下に確実に病変を同定・切除できる、③多発病変にも対応できる、などがあります。さらにはCT上早期肺がんと考えられる73例に対しても十分なマージンをとった切除ができており、全例で局所再発は認めておらず、根治性を担保するために必要不可欠な方法となっています。
図1
図2
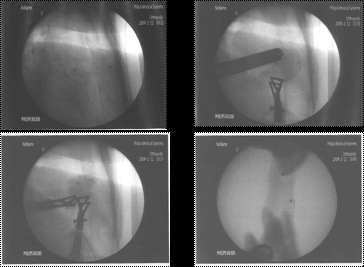
図3
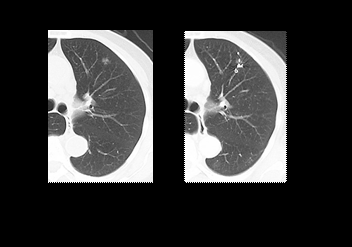
図4
非小細胞肺癌の内科的治療
肺癌は、小細胞癌と非小細胞癌の2種類に大きく分けられます。
非小細胞癌は肺癌の約80%を占め、腺癌・扁平上皮癌・大細胞癌に細分され、抗癌剤が比較的効きにくいという特徴があり、進行度に応じた治療を行います。
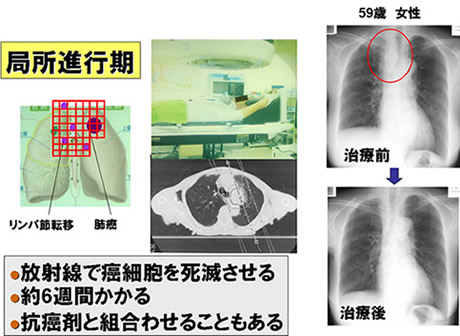
早期の非小細胞癌に対しては手術が適応となりますが、病状がある程度進行した状態、例えば縦隔リンパ節転移のある局所進行癌(Ⅲ期)の場合には放射線治療を行います。放射線治療は、癌のところだけに放射線を当てて癌細胞を死滅させる治療法で、毎日少しずつ放射線を当てるので治療に6週間程度かかります。(図3)
効果を上げるために抗癌剤と一緒に組み合わせて行うこともよくあります。
放射線治療(図1)
早期の非小細胞癌に対しては手術が適応となりますが、病状がある程度進行した状態、例えば縦隔リンパ節転移のある局所進行癌(Ⅲ期)の場合には放射線治療を行います。放射線治療は、がんのあるところすべてに放射線を当ててがん細胞を死滅させる治療法で、毎日少しずつ放射線を当てるので治療に6週間程度かかります。(図3)。効果を上げるために抗がん剤と一緒に組み合わせて行う化学放射線療法も行われており、最近では、化学放射線療法の後に再発が認められないときには、免疫チェックポイント阻害剤による地固め療法を行う場合があります。
また、Ⅰ、Ⅱ期の非小細胞肺癌の患者さんで、医学的な理由で手術ができない、手術を希望しない等の場合にも、放射線治療を行う場合があります。
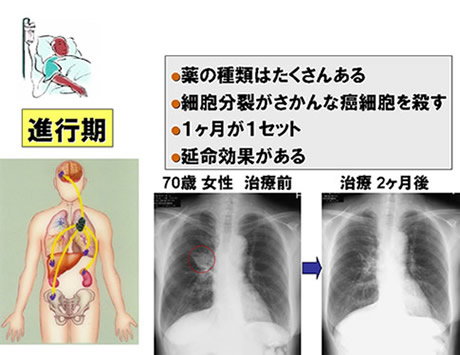
抗癌剤治療(図2)
肺癌においては、ここ数年で新しい治療法が登場しました。
それが分子標的治療です。
分子標的治療という言葉は聞きなれないかもしれませんが、これは、癌が広がっていくのに必要な物質、分子だけを標的にした薬です。
その代表がゲフィチニブ(商品名: イレッサ)およびエルロチニブ(商品名:タルセバ)です。
これらの薬の標的は、上皮成長因子受容体というもので、肺癌細胞の表面に出ているのですが、ここから癌細胞が分裂するのに必要な刺激が入ってきます。
イレッサやタルセバはその刺激をブロック(通行止めに)することで、癌細胞が増えるのを抑えます。イレッサやタルセバによって、10-20%の肺癌患者さんにおいて癌が半分以下に縮小させる効果が得られます。また、約50%の肺癌患者さんでは何らかの症状の改善がみられます。ただし、その使用に際しては代わりの治療法と比較してどちらがよいか医師と充分相談する必要があります。
イレッサやタルセバは、効く人には劇的に効く場合が多いのですが、副作用はどうでしょうか(図5)。いくら癌に標的を絞っているといっても、やはり副作用は出てしまいます。頻度が多いものは皮疹(にきび)、下痢、それから肝臓の障害です。しかし、これらは軽いものが多く、イレッサやタルセバを飲むのをやめればほとんどの場合回復します。また、抗癌剤で必ず出る骨髄毒性がないのもイレッサやタルセバのいいところです。ところが、注意しなければならないのが肺障害(間質性肺炎)です。約6%の患者さんに発症し、致命的になることがありますので、この薬の治療は肺癌の治療経験を積んだ医師のもとで受ける必要があります。
イレッサの副作用(図3)
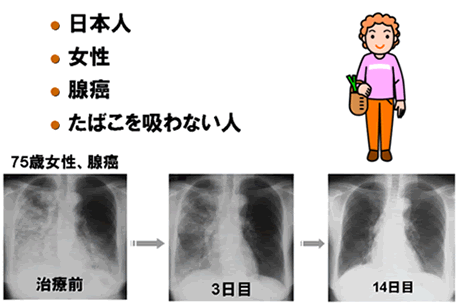
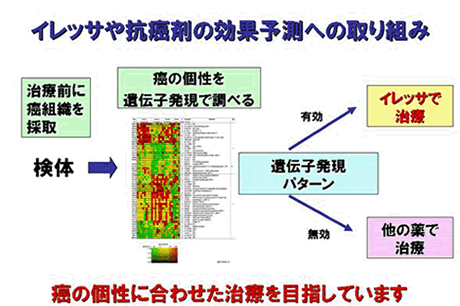
イレッサやタルセバはどのような肺癌患者さんに効きやすいのでしょうか。それは、日本人、女性、非小細胞癌のなかの腺癌という組織型、それからたばこを吸わない患者さんです。レントゲン写真はそれらの条件を全て満たした70歳代の女性のものです。広い範囲に広がっていた肺腺癌の影が、イレッサの治療を続けることにより1ヶ月後にはほとんど消えました。薬を飲み続けることでこの効果は2年9ヶ月続きました(図6)。このように、イレッサは劇的な効果が期待できるが致死的な副作用が起きる可能性もある薬剤です。そこで、徳島大学では特にイレッサの効果を予測する検査法の開発に取り組んでいます。具体的には、治療の前に癌組織を採取させて頂き、癌細胞の個性を遺伝子発現で調べます。今までの研究によってイレッサが効く遺伝子発現のパターンと効かないパターンがわかってきましたので、効くパターンの患者さんにはイレッサで治療をする。効かないパターンの人には他の治療をするという、癌の個性に合わせた治療を目指しています(図7)。徳島大学ではイレッサに限らず新しい抗癌剤についても効果を予測する検査を開発するための研究に取り組んでいます。
当院では、急性期病院としての役割を果たすことを主眼においております。
よって主に周術期の治療と術後急性期(約半年)の経過観察を担当します。
その後は、かかりつけの先生もしくはご紹介いただいた先生に経過を見ていただく方針としています。
そのために医療者用(当院・かかりつけ医)と患者様用の術後チェックリストを作成し三者にて情報を共有します。
そのチェックリストをもとに診察・検査を行い、再発の有無をチェックしていきます。
(図4)
(図5)
内視鏡的治療
光線力学的治療(PDT)
当科では以前から光線力学療法(PDT)にも取り組んでいます。PDTとはレーザー治療の一種です。肺がん、食道がん、胃がん、子宮頸がんに保険適用されています。レーザーと言ってもがんを直接焼く治療ではありません。治療に先だって光感受性物質という薬剤を投与します。これは正常組織よりもがん組織に取り込まれやすいという性質があります。そこでレーザーをがんに当てると光感受性物質が光エネルギーを吸収し、化学反応により活性酸素が発生します。それによってがんを破壊するという原理です。
肺がんに対する適応は中心型の早期がんに限られます。中心型とは気管支鏡で見える範囲の太い気管支に発生したものです。なおかつ気管支表層にとどまっていること、2㎝以下、がんの一番奥まで気管支鏡で確認できること、扁平上皮がんであることが挙げられます。具体的な治療の流れですが、まず光感受性物質を点滴投与し、約4時間後に気管支鏡を介してレーザー照射を行います。約30分の治療時間を要するため当科では主に全身麻酔で行っています。
PDTの副作用ですが、光感受性物質はがん以外の正常組織にも取り込まれます。そのため治療後には皮膚に残存した物質が日光や明るい電灯の下で反応し、やけどした様な状態になります。これを防ぐため治療後はやや暗めの室内で過ごしてもらうことが望ましいです。光感受性物質は数日で消失しますので、それまでの間は部屋の明るさを管理するために個室入院としています。
PDTは肺を切除する外科手術とは違い、肺を温存しますので治療後の呼吸機能低下がありません。呼吸機能が悪くて手術できない方、多発している場合や再発例でも繰り返して行えます。ただし適応となるのはあくまで早期の中心型肺がんであり、早期発見が非常に重要です。レントゲンやCTで見つかるものではありませんので、ヘビースモーカーの方、血痰、長引く咳などの症状が続いている方は、痰の細胞検査や気管支鏡検査を受けて頂くのをお勧めします。
中枢気道狭窄に対する治療
腫瘍や外傷、結核などの後遺症で気管狭窄を起こし、呼吸困難の原因となることがあります。その際には硬性鏡や気管支鏡を用いて、レーザーなどで焼灼し、狭窄部を解除する治療を行います。その後、必要に応じてステントと呼ばれる器具を狭窄部に留置し、気道を確保する治療を行います。ステントにはシリコン製のもの、金属製のものなど病変の特徴に応じて使い分けています。
1.狭窄部を解除するための治療
YAG(Yttrium Aluminum Garnet)レーザー、高周波スネア、硬性鏡による機械的切除、バルーン拡張などにより狭窄部を解除し、気道の内腔を確保します。
2.気道ステント
気道ステントを留置する目的は、狭窄を解除し、呼吸困難などの症状を緩和する目的がほとんどです。対象疾患には、①悪性疾患(肺癌、食道癌、甲状腺癌、転移性肺腫瘍、縦隔リンパ節転移など)、②良性疾患(気管切開後瘢痕狭窄、気管支結核、気管軟化症など)、③気管・気管支食道瘻などがあります。一般的な適応は、①50%以上の狭窄、②呼吸困難などの自覚症状が強い、③狭窄部より末梢の肺機能・血流が保たれている、④3か月以上予後が期待できる、などといわれていますが、個々の患者様の状況によります。

< 図1.各種気道ステント >
集学的治療
術後化学療法
術後に切除した肺組織やリンパ節を調べて病理病期を確定します。
術後病期IB, II, IIIA期の肺癌に対しては術後に抗癌剤による化学療法を行うことで,手術単独の場合よりさらなる予後の改善が期待されます。
使用する抗ガン剤には,内服薬と注射薬があります。
ユーエフティ(UFT)が内服薬では良く用いられます。
最近ではUFTの他にティーエスワン(TS-1)という内服薬が用いられることもあります。
注射薬としてはシスプラチンやカルボプラチンといったプラチナ製剤,タキソール,タキソテール,ナベルビン,ジェムザールといった薬があり,2種類の組合せや,単剤で使用されます。
注射薬の抗癌剤を使用する場合には,最初は入院にして投与し,副作用が強く出ないかどうかを見極めたうえで,原則的には外来通院にて一定期間の化学療法を行います。 IB期の肺癌に対してはUFTもしくはプラチナ製剤ベースの併用療法(プラチナ製剤に別の種類の抗癌剤を組み合わせて治療する方法)が考慮されます。
II, IIIA期の肺癌に対してはプラチナ製剤ベースの併用療法が考慮されます。
IA期の肺癌は術後抗癌剤のメリットは少ないと思われますが,IA期でも癌が2cmより大きいものに関してはUFTの内服を考慮します。
術前化学療法
I期,II期の肺癌に対しては手術前に抗癌剤による術前化学療法はげんぞく的に行いません。
手術が可能ならまず手術を優先し,術後に抗癌剤による化学療法(上述の術後化学療法を参照)を考慮します。
術前検査で明らかなIIIA期の肺癌に対しては,術前化学療法を行い抗癌剤による効果をみて手術を行うかどうかを判断する場合が多くなっています。
術前化学療法後に手術を行った場合には,術後も何らかの化学療法を行うのが一般的です。
肺癌が胸壁浸潤しているけれども,リンパ節転移が認められない場合には抗癌剤と放射線による術前化学放射線療法を行ってから手術を行う場合があります。
Ⅳ期非小細胞肺癌の薬物療法
Ⅳ期の非小細胞肺癌で用いられる薬物療法では、細胞分裂が盛んながん細胞に取り込まれることによってがん細胞に対して効果を発揮する、『細胞障害性抗がん剤』がその中心を担ってきました。2000年代以降になって、分子標的治療薬、免疫チェックポイント阻害剤といった新規治療が登場し、有効性が示されてきました。
分子標的治療薬の多くは、EGFR遺伝子変異、ALK遺伝子転座、ROS1遺伝子転座、BRAF遺伝子変異といったがん発生の直接的な原因となるようなドライバーと称される遺伝子変異/転座がある場合、これらに直接作用し、効果を発揮する薬剤です。
2015年以降、本邦で使用可能となった免疫チェックポイント阻害剤は、細胞障害性抗がん剤や分子標的治療薬と異なる作用機序を有する薬剤で、腫瘍免疫における負の調節因子であるPD-1などの免疫チェックポイント分子を標的とした薬です。PD-L1陽性腫瘍細胞が一定以上の非小細胞肺癌において有効性が高く、近年では免疫チェックポイント阻害剤単剤だけでなく、細胞障害性抗がん剤との併用においても効果が示されています。
従って、Ⅳ期非小細胞肺癌の治療方針は、がん発生の直接的な原因となるドライバー遺伝子変異/転座や、免疫チェックポイント阻害剤の効果予測に使用されるPD-L1陽性細胞の状況を参考に、治療を決定しています。そこで、通常は組織診断が確定した後に、病期診断を考慮して遺伝子変異/転座の有無とPD-L1の発現状況を、採取した組織や血液を用いて確認し、これらの薬剤を適切なタイミングで使用します(図●)。
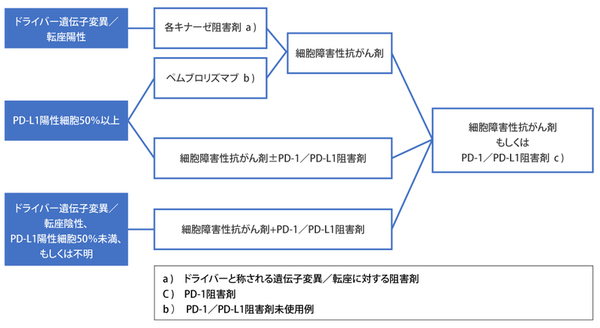
図● 肺癌診療ガイドライン―悪性中皮腫・胸腺腫含む―2018年度版より一部改変
【小細胞肺癌】
小細胞肺癌は肺癌全体の約15-20%を占める腫瘍です。 小細胞肺癌は進行が早く、早期に全身転移が認められるため外科切除の対象となることはほとんどありません。一方で抗がん剤治療や放射線療法が有効であることが多いという特徴を持っています。
小細胞肺癌の進行度は限局型(LD)と進展型(ED)に大きく分けられます。 限局型はがんが片側の肺および肺門・縦隔・鎖骨上窩リンパ節などに限局しており、悪性胸水、心嚢水を伴わないものであり、進展型は以上の範囲を越えて進行している状態(全身転移など)です。
限局型(LD)の治療の主体は薬物療法と放射線治療の併用療法ですが、臨床病期 Ⅰ、ⅡA期においては外科治療を含む治療の適応になります。
臨床病期 Ⅰ、ⅡA期以外の限局型(LD)の治療は、薬物療法と放射線治療の併用が標準治療と考えられています。放射線治療と併用する薬物療法は、今までの比較試験の結果などからシスプラチンとエトポシドの併用療法(PE療法)を行っています。
進行型(ED)における治療の主体は薬物療法です。今までの比較試験の結果から、全身状態や年齢で推奨される薬物が異なっています。70歳以下で比較的全身状態が良い場合においては、PE療法又はシスプラチンとイリノテカンの併用療法等が行われます。71歳以上75歳未満およびイリノテカンの毒性(下痢や間質性肺炎の併存など)が懸念される症例にはPE療法が推奨されています。高齢者等のあまり強い治療が困難な場合は、カルボプラチンとエトポシドの併用(CE療法)等が行われます。
小細胞肺癌は初回の抗がん剤治療や放射線療法に反応して縮小することが多いのですが、再発率も高く、再発した場合には抗がん剤治療が中心となります。
