胃癌・胃腫瘍
1.胃の機能と構造
胃 はお腹の中にある臓器で、口から食べた食物が食道を通って胃に入ります。
胃は酸やタンパク質を分解する物質や粘液などを分泌します。
胃内に入った食物はし ばらく停滞し、殺菌作用のある胃液と混和、粉砕されて、少しずつ十二指腸から小腸へ送り出されます。食物からの栄養の消化吸収は主に十二指腸以下の小腸の 役割で行われ、胃は主にその準備を行っています。
食道から胃への入口を噴門、胃から十二指腸への出口を幽門、幽門の口側の部を幽門洞、胃の入口に近い部位を胃体部といいます。
胃体部からは胃酸やビタミン B12を吸収するための内因子を分泌し、幽門前庭部は胃酸の分泌を調節するガストリンというホルモンを出しています。
胃の酸分泌や食物を送り出す運動はこ のようなホルモンや神経によって複雑に
調整されています。
また、胃の壁は、最内層が胃液や粘液を分泌する粘膜、次に胃の運動を行う筋肉(固有筋層)、最外層は漿膜と呼ばれる薄い膜で覆われています。
さらに粘膜と固有筋層の間の粘膜下層、固有筋層と漿膜の間の漿膜下層を加え
5層で構成されています。
2.胃がんの進行度
胃 粘膜に発生した胃がんは、何年もかかって検査で発見可能な数mm大の大きさになり、放置すると胃壁を外に向かって粘膜下層、固有筋層、漿膜下層、漿膜へと 徐々に深く進んで行きます。発育の方向として、管腔内への隆起、水平方向への拡大もみられ、主に水平方向へ浸潤していく種類のがんもあります。
胃壁へ深く進んで行くに従って、リンパ管や血管に入り込んでがん細胞が拡がる可能性が高まり、リンパ節や肝臓や肺といった遠くの臓器にがんが生じる場合が あります。
これを転移と呼んでいます。さらに胃壁を突き抜けると、近くの大腸や膵臓など他の臓器に直接浸潤したり、お腹全体にがん細胞が散らばったりします。
このようにリンパ管に入ってリンパ節に転移することをリンパ行性転移、血液に乗って肝臓や肺などに転移することを血行性転移、お腹全体にがん細胞が散らばる転移を腹膜播種といいます。
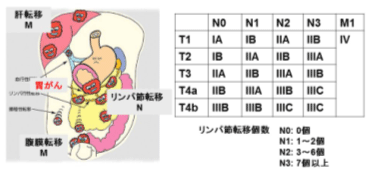
こういう理由で、どのくらい深く胃壁へ進んだか、これを深達度といいますが、これは胃がんの進行度を決める大きな因子の一つです。さらにリンパ節転移の個数が増えるにしたがって進行度が上がり、当然ないのが一番よいのですが、N1: 1~2個、N2: 3~6個、N3: 7個以上と決められています。
リンパ節転移は一般的に胃に近いところから進み、最終的には腹部大動脈の周りや、そこからさらに遠くのリンパ節に転移しますが、これらは遠隔転移とみなされます。
この他に遠隔転移にあたるのは腹膜播種と肝転移ですが、どの場合もかなりの進行がんで、治療は困難です。
深達度とリンパ節転移の程度、遠隔転移の有無を組み合わせて図1のように進行度(ステージ)が決定され、I、IIA、IIB、IIC、IIIA、IIIB、IIIC、IVに
分類されています。
これは長年にわたる治療成績の検討の結果、手術後の再発や生存期間を予測するものとなっています。
早期の胃がんは無症状のことも多いのですが、上腹部痛や不快感、出血のために発見されることがあります。進行すると食欲不振、体重減少、胃を食物が通れなくなることによる嘔吐、貧血やそれによって引き起こされる動悸などを訴える場合があります。早期胃がんとは、深達度が粘膜下層までのがんをいいます。
リンパ節転移は、早期がんでも 発生します。
【図1】
3.治療方法

2001 年に日本胃癌学会から胃がん治療ガイドラインが出され、2018年1月第5版(図1)に
改訂されました。
胃癌の進行度に見合った、現時点における最適治療法の適応の目安を示し、
あらゆる病院、医師が胃がん治療における施設間格差を少なくすることを目的に、
このガイドラインに従って、統一的に適正治療を選択し、標準化する努力がなされています。 図2はガイドラインに示された標準治療を転載しています。
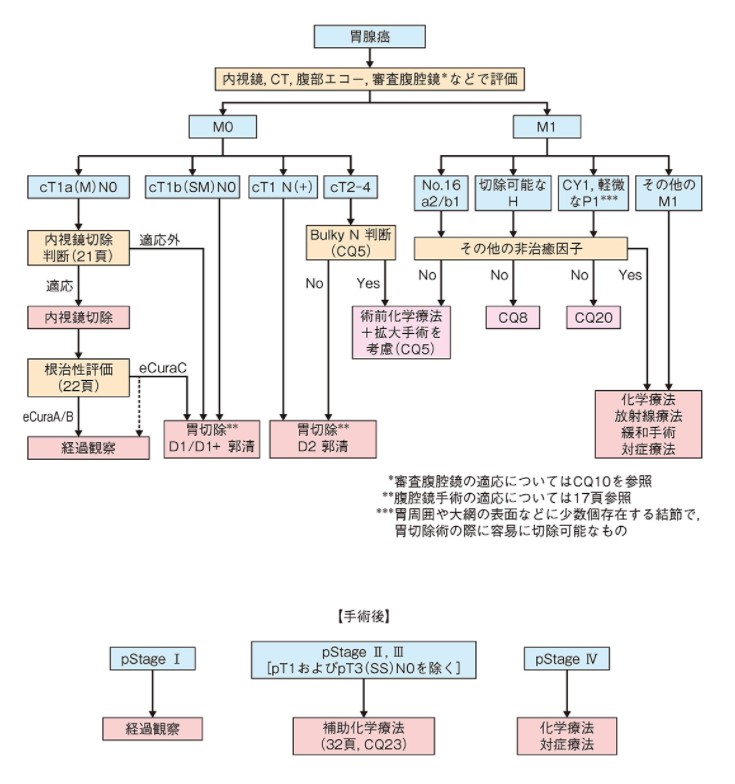
【図2:胃癌治療アルゴリズム(胃癌治療ガイドライン第5版より引用】
3-1. 内視鏡的治療
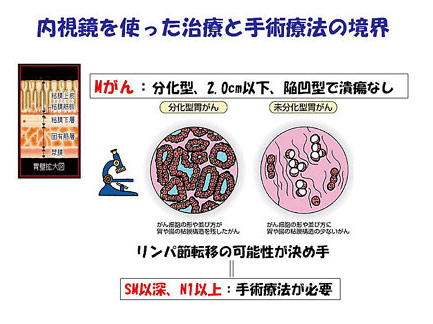
過去の全国の胃がん患者の臨床成績の結果から深達度、大きさや形態、内視鏡下生検から判明したがんの分化度(顕微鏡で見て胃の正常の粘膜によく似た固まりを 作るがんを高分化、そうでないものを低分化といいます。)などを総合してリンパ節転移の少ない胃がんがあることが分かってきました。この種類のがんはリン パ節転移がなければそれを取る必要がないので、内視鏡的に治療可能ということになります。
このような癌に対する治療は内視鏡的粘膜切除術が代表的ですが、ほかに内視鏡的レーザー治療、光線化学療法などがあります。
内視鏡的粘膜切除術はおなかを開けず(開腹を行わず)に、内視鏡下にがんの下に生理食塩水などを注入して病変部を浮き上がらせ、特殊な道具を用いてがんの周囲の正常な粘膜をつけて切りとる治療です。
小さな病変の場合は20、30分で終了できます(EMR:内視鏡下粘膜切除術)。ただし、大きな病変の場合は1、2時間かかることもあります(ESD:内視鏡的粘膜下層剥離術)。ここまでの治療は通常は消化器内科で行われます。
しかし、この治療の適応外の症例や、内視鏡下に切除した病巣を顕微鏡で見た結果、予想より深いところまでがんが及んでいたり、血管やリンパ管に入り込む場合では、リンパ節に転移している可能性が高くなりますので、外科手術を追加する適応となります。
【図3】
3-2. 外科療法
手術は今日でも最も有効で確実な治療手段です。
胃がんはその深さ(深達度)によって早期がんと進行癌に分けることができます。ガイドラインによりますと、早期がんの段階でもリンパ節転移が起こりうるため、外科療法は、がんを含めた胃の切除のみならず、周辺のリンパ節や若干遠いリンパ節の切除が重要な要素を占めます。
これは術中に転移が明らかな場合だけでなく、肉眼的に転移が明らかでなくても予防的に行われ、これをリンパ節郭清といいます。このように治癒を期待して行う手術を根治手術と呼び、この場合は主病巣の局在に応じてリンパ節郭清の範囲がガイドラインで定められています(上記表)。また、臨床ステージに応じてリ ンパ節郭清の範囲が異なります。
縮小手術と定型手術
縮小手術
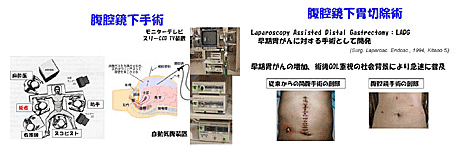
これはステージIAの内視鏡的治療の対象外やIBの一部に対する手術で、定型手術よりは胃の切除範囲もリンパ節郭清も少なくする手術です。一般に早期癌なので、切除範囲、リンパ節郭清範囲が少なくて済むので、 手術はできるだけ患者さんに負担をかけない、低侵襲手術を目指す意味で、腹腔鏡下手術で行うことが第一選択となることがあります。この手術は腹部に0.5-1cm 程度の穴を4-5カ所あけて腹腔鏡というカメラで観察しながら胃の切除を行います。胃を切除した後は食事が通るように再建をしますが、この消化管再建を 約5cmの小さい開腹創から行います。手術創が小さくすむと痛みが少なく、術後の回復が早いため、少しでも患者さんの負担を軽減するためにこのような術式を取り入れています。当科では日本内視鏡外科学会の技術認定医が手術を行っています。手術後の体力や食事摂取はほとんど低下せず、手術後の積極的な痛み 対策、食事指導の徹底により胃がんの手術を受けた後の入院期間は、通常11日程度と短くなっています。就業中の患者さんの大多数が、手術後1ヶ月程度で職場復帰されています。
【図4】
定型手術
これはステージIBの一部からIIICまでの癌に対する手術です。腹膜播種などの遠隔転移がなく、患者さんに負担をかけてリンパ節郭清をしても、根治性・延命効果が期待される場合に行われますので切除範囲やリンパ節郭清範囲はやや広くなります。病変の大きさ、部位によって胃の切除範囲が異なり、幽門側切除術、噴門側切除術、全摘術さらに 胃がんが隣接する他臓器に直接広がっている場合は、その臓器の合併切除を行うことがあります。
姑息手術
これは主病巣をおいておくと出血が止まらなく なったり、がんが大きくなって胃の狭窄を来し、食事が口から摂れなくなったりすることを避けるために行うものです。さらに主病巣の切除すら困難な場合は食 物が通るようバイパスをつくる手術が行われる場合もあります。このような手術は姑息的手術と呼ばれています。
また十分根治手術可能と思われても、患者さんの状態や合併症によって手術を縮小せざるをえない場合もあります。
術式の紹介
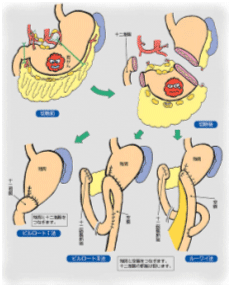
幽門側胃切除術
胃がんは胃下部に発生することが多いので、胃の出口の方の2/3を切除する幽門側胃切除術が最も多く行われています。
再建は残った胃と十二指腸を直接吻合するビルロートI法で行っています。
残った胃が小さくなったような場合、その胃と十二指腸の間に空腸(小腸の口側の部)をいれる空腸間置法という方法や十二指腸を閉鎖して残った胃と空腸をつなぐRoux-en Y(ルーワイ)法という再建行います。
十二指腸を食物が通る方が生理的と考えられていますが、まだどの再建がベストなのか決定的ではありません。
【図5】
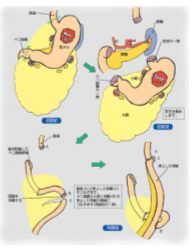
噴門側胃切除術
胃がんが噴門に近い場合には、噴門寄りの胃を切除する噴門側胃切除術も行われています。食道と残った胃を直接吻合すると胆汁や膵液の逆流で食道に炎症が生じるため、空腸を食道と残った胃の間に間置します。
胃全摘術
術後の食事摂取に関しては、幽門側胃切除のほうが全摘より良いのでできるだけ胃は残したいのですが、深達度が深く、がんの拡がりが著明な場合など前述の術式では不十分と考えられれば胃を全部切除する胃全摘術を行います。
空腸間置やRoux-en Y再建を行います。
【図6】
手術に伴う合併症
胃がん手術後の合併症としては、以下のものがあります。
○膵液漏
合併症としては、最も頻度の高く、主に胃全摘後におこります。膵臓周囲のリンパ節を切除する時に膵臓が傷つき膵臓が分泌する膵液(消化液)が漏れること が原因です。消化液が周囲組織に炎症を起こし腹痛、発熱がおこります。治療は、絶食と膵液の産生をおさえる注射をおこない、多くの場合はこの治療で治癒が得られます。
○縫合不全
消化管をつないだ部分がくっつかないことにより、消化管の内容物が漏れてしまうことです。食道と小腸をつないだ場合におこることがあります。ほとんどの場合、絶食にて自然治癒します。
○その他
全身麻酔に伴う合併症としては、無気肺(肺に貯まった痰が気を閉塞して肺が一部つぶれてしまうこと)、肺炎があります。手術に伴うものとして、術後出血、創感染(切開した傷が化膿する)、腸閉塞(術後に腹腔内に癒着がおこり腸がねじれてしまうこと)があります。
3-3. 薬物療法
いわゆる抗がん剤や分子標的薬を使用する化学療法のことです。胃がんに使用される抗がん剤にはいくつかありますが,注射や飲み薬として5-FUとその仲間が最も多く使われています。特にS-1という飲み薬は高い効果が期待でき、比較的副作用も少ないので広く使用されています。S-1の他にも胃がんに対し高い効果を示す新しい薬剤 (タキサン系抗がん剤、CPT-11、シスプラチンなど)が開発承認されています。
近年、分子標的薬が乳がん、大腸癌がん、肺がんなどの治療に広く取り入れられ、一部の胃がんにも適応とされています。分子標的薬は1980年代以降に、がんの分子生物学が進歩したことを背景に開発された薬剤で、がん細胞の増殖や転移などに関する特異な性質を分子レベルで解明し、これを抑える治療薬です。従来の抗がん剤にこれら分子標的治療を取り入れた集学的治療により、進行胃がんの治療成績の向上が期待されています。
化学療法は手術に次ぐ第2の治療法とされていますが、現在でも根治手術が期待され、全身の状態が手術可能な人に化学療法だけを行うことは絶対にありません。化学療法を第1に選択したと しても,がんの進行度と手術のタイミングを考慮して治療するのが普通です。化学療法は抗がん剤を使用する目的によって,(1)肉眼的には手術でがんが取りきれているが再発を予防する(これを補助化学療法と言います),(2)がんがあることが証明されていて治療目的で使用する,の2つに分類されます。また, 対象とする部位によって,(3)全身化学療法と(4)局所化学療法の2つに分類されます。また,手術の時期との関連で,(5)術前化学療法,(6)術中化学療法,(7)術後化学療法の3つに分類されることもあります。
最も多く行われていますのは,(1)または(2)の目的で(3)を(7)の時期に行うことです。
この中で、(1),(3),(7)の組合せは術後補助化学療法と言われます。ステージ1の術後には抗がん剤治療を行わなくても再発は少ないので不要とされています。ステージ2、3の進行胃がんに対して術後1年間S-1を服用する大規模な臨床試験が日本で行われ、S-1が再発を抑える効果が立証されましたので、術後1年間のS-1服用は標準治療とされています。
さらに,(2)と(3)組み合わせで、遠隔転移があり、手術を行っても根治性が期待できない方や、再発症例に対し、S-1にシスプラチンを追加することで、生存期間が延長されることが臨床試験で確認され、標準治療となっています。しかし、この治療は腎臓に負担がかり、その対策としてシスプラチンという薬を投与する前後数日の入院が必要になります。この入院が不要な治療法を目指し、S-1にオキサリプラチンを追加する治療が検討され、シスプラチンと同等の効果が確認され、この治療法は外来でも可能なため標準治療の一つとなりました。
トラスツズマブは、がんの細胞表面のHER2と呼ばれるたんぱく質だけに作用して、がん細胞の増殖を阻害する分子標的薬で、従来の抗がん剤に追加することで生存期間が延長されることが臨床試験で確認されました。またがん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の胃癌に対し、トラスツズマブ デルクステカンが胃癌での効果が確認されました。ただしHER2が表面に存在する胃がんは全体の約20%で、これらの方にしか効果が期待できないのが現状です。
残念ながら、初回の化学療法の効果がなくなったときに抗癌剤の変更を検討します。二次治療としてはパクリタキセルとラムシルマブの併用療法の生存期間の延長が示されたため、現在の標準治療となっています。また何らかの理由でこの併用療法ができない場合は、イリノテカン、パクリタキセル、ドセタキセル、ラムシルマブを単独での治療を行うこともあります。
その他に多くの抗がん剤や分子標的薬の併用が試みられていますが、2021年4月現在、効果が証明された治療法はこれまでに記した治療法のみです。
また、薬物療法の一つに免疫療法があります。がん細胞が免疫から逃れようと体内の免疫(T細胞など)にブレーキをかけるのを防いで、体内にもともとある免疫細胞の活性化を持続する薬です。胃癌に対してニボルマブ、ペンブロリズマブが保険適用されています。
3-4.放射線療法
放射線は,胃がんに対する効果が弱いうえに,正常な大腸や小腸を損傷しやすいため,通常は胃がんに対して放射線を照射することはありません。しかし,脳や骨やリンパ節などに転移が起きたときに,その転移部位に放射線をかけることがあります。
胃癌学会HP:
http://www.jgca.jp/
徳島大学大学院 医歯薬学研究部 消化器・移植外科HP:
http://tokugeka.com/surg1/
徳島大学大学院 医歯薬学研究部 消化器内科学HP:
http://www.tokudai-shoukaki.jp/
